2 × mix Taq Platinum PCR
Definice aktivity
1 jednotka (U) Taq Platinová DNA polymerázová aktivita je definována jako množství enzymu potřebné k začlenění 10 nmol deoxynukleotidů do látek nerozpustných v kyselině při 74 ° C do 30 minut s použitím aktivované DNA spermatu lososa jako templátu/primeru.
Kontrola kvality
Čistota pomocí detekce SDS-PAGE je více než 99%; Nebyla detekována žádná aktivita exogenní nukleázy; Jednokopírovací gen v lidském genomu by mohl být účinně amplifikován; Při skladování při pokojové teplotě po dobu jednoho týdne nedochází k žádné významné změně aktivity.
Hlavní technické parametry
Má 5'-3 'exonukleázovou aktivitu a 3'-5' exonukleázovou aktivitu a jeho věrnost je vedle Pfu polymerázy. Rychlost rozšíření Taq Platinum Polymerase je rychlejší než Pfu polymerase a účinnost zesílení je vyšší. PCR produkty mohou být přímo ligovány na tupý konec nebo klonovány TA vektorem. Pokud je třeba zlepšit účinnost klonování, doporučuje se před klonováním do TA vektoru nejprve vyčistit a přidat převisy 3'-dA.
One-tube Taq Platinum MasterMix (National High-Tech Product Certification)
■ Taq Platinum MasterMix má zlepšenou specificitu a citlivost PCR reakce a může zesilovat komplexní šablony s vysokým obsahem GC, sekundární strukturou a podobně. Lze zesílit až 2 kopie cílové šablony, což zajistí přesnější experimentální výsledky.
■ Unikátní vzorec Taq Platinum MasterMix činí celý reakční systém velmi stabilním a aktivita nebude ovlivněna opakovaným zmrazováním a rozmrazováním nebo dlouhodobým skladováním při 4 ° C.
■ Stabilní a účinný předem připravený směsný roztok PCR může urychlit a zjednodušit operaci, což výrazně sníží intenzitu práce a chyby vzorkování. Součástí směsi je také vysoce výkonný zesilovač a optimalizátor PCR, který snižuje požadavky na podmínky PCR.
■ Tento výrobek má systémy obsahující barviva i bez barviv. Produkty MasterMix obsahující barvivo lze po PCR přímo elektroforetovat, bez přidání zaváděcího pufru.
Aplikace
Může nahradit Pfu polymerázu k amplifikaci vysoce věrných produktů ze složitých templátů, jako jsou genomy, a je vhodný pro aplikace, jako je klonování expresních genů, místně specifické mutace a analýza polymorfismu jednoho nukleotidu (SNP) atd.
Opatření při navrhování primerů PCR:
Délka primeru je obvykle 20-25 mer. Při provádění dlouhé fragmentové PCR by však délka primeru měla být zvýšena na 30-35 mer.
■ Mezi oběma primery neexistuje žádné komplementární párování, zvláště u posledních 3 bází na 3 'konci.
■ Obsah GC by měl být 50–60%a vyhněte se místnímu bohatému GC nebo AT. Aby se primer a templát vázaly stabilně, vyhněte se struktuře bohaté na AT na 3 'konci.
■ Vyhněte se primerům, abyste vytvořili sekundární strukturu.
■ Vyberte dva primery s teplotami Tm blízko sebe.
Výpočet hodnoty Tm primerů pro PCR:
■ Když je primer menší než 20 mer: Tm = 2 ° C × (A+T)+4 ° C × (G+C).
■ Když je primer více než 20 mer: Tm = 81,5+0,41 × (GC%)-600/L, kde L je délka primeru.
■ Nastavte teplotu žíhání na (Tm-5) ° C.
Vstup primeru PCR
Příslušnou konečnou koncentraci primerů lze vybrat mezi 0,1 μM a 1,0 μM. Příliš nízká koncentrace primeru vede k nízkému výtěžku amplifikačních produktů, zatímco příliš vysoká koncentrace primeru je náchylnější k nespecifické amplifikaci. Obvykle, když je množství templátové DNA velké nebo je jako templát použita komplexní templátová DNA (jako je DNA lidského genomu), koncentrace primerů by měla být nižší. Pokud je množství templátové DNA malé nebo se jako templát použije jednoduchá templátová DNA (např. Plazmidová DNA atd.), Měla by být koncentrace primeru vyšší.
Všechny produkty lze přizpůsobit pro ODM/OEM. Pro detaily,klikněte prosím na přizpůsobenou službu (ODM/OEM)
 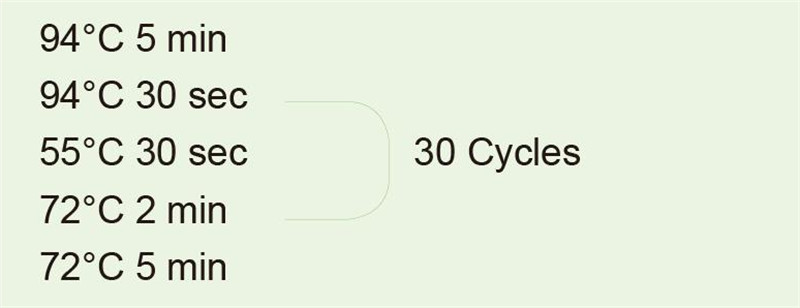 |
K amplifikaci 1 kb fragmentu použijte genomovou DNA jako templát. Po reakci PCR odeberte 5 μl pro detekci elektroforézy. |
Šablona A-1
■ Šablona obsahuje proteinové nečistoty nebo inhibitory Taq atd. —— Čistěte templát DNA, odstraňte proteinové nečistoty nebo extrahujte templátovou DNA pomocí purifikačních souprav.
■ Denaturace šablony není úplná —— Vhodně zvyšte denaturační teplotu a prodlužte denaturační čas.
■ Degradace šablony —— Připravte šablonu znovu.
Základní nátěr A-2
■ Špatná kvalita primerů-Znovu syntetizujte primer.
■ Degradace primerů —— Alikvotujte primery s vysokou koncentrací do malého objemu pro uchování. Vyvarujte se vícenásobného zmrazení a rozmrazení nebo dlouhodobé kryokonzervované na 4 ° C.
■ Nesprávný design primerů (např. Nedostatečná délka primeru, dimer vytvořený mezi primery atd.) -Přepracovat primery (vyhnout se tvorbě dimeru primeru a sekundární struktury)
A-3 Mg2+koncentrace
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 Teplota žíhání
■ Vysoká teplota žíhání ovlivňuje vazbu primeru a šablony. —— Snižte teplotu žíhání a optimalizujte stav s gradientem 2 ° C.
A-5 Doba prodloužení
■ Krátká doba prodloužení —— Prodlužte dobu prodloužení.
Fenomény: Negativní vzorky také ukazují pásma cílové sekvence.
A-1 Kontaminace PCR
■ Křížová kontaminace cílové sekvence nebo amplifikačních produktů —— Opatrně nepipetujte vzorek obsahující cílovou sekvenci do negativního vzorku ani je nevylijte z centrifugační zkumavky. Činidla nebo zařízení by měla být autoklávována, aby se odstranily stávající nukleové kyseliny, a existence kontaminace by měla být stanovena pomocí experimentů s negativní kontrolou.
■ Kontaminace reagencií ——Realizujte reagencie a skladujte při nízké teplotě.
A-2 Primer
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
■ Nesprávný design primerů a cílová sekvence má homologii s necílovou sekvencí. —— Přepracovat základní nátěry.
Jev: Pásy amplifikace PCR jsou v rozporu s očekávanou velikostí, buď velké nebo malé, nebo se někdy vyskytují jak specifické amplifikační pásy, tak nespecifické amplifikační pásy.
Základní nátěr A-1
■ Špatná specificita primeru
—— Re-design primer.
■ Koncentrace primeru je příliš vysoká —— Správně zvyšte denaturační teplotu a prodlužte denaturační čas.
A-2 Mg2+ koncentrace
■ Mg2+ koncentrace je příliš vysoká —— Správně snižte koncentraci Mg2+: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-3 Termostabilní polymeráza
■ Nadměrné množství enzymu —— Množství enzymu přiměřeně snižte v intervalech 0,5 U.
A-4 Teplota žíhání
■ Teplota žíhání je příliš nízká —— Vhodně zvyšte teplotu žíhání nebo použijte dvoustupňovou metodu žíhání
A-5 PCR cykly
■ Příliš mnoho cyklů PCR — Snižte počet cyklů PCR.
Základní nátěr A-1——Špatná specifičnost ——Předělejte základní nátěr, změňte polohu a délku základního nátěru, abyste zvýšili jeho specifičnost; nebo proveďte vnořenou PCR.
A-2 DNA šablony
——Šablona není čistá —— Purifikujte šablonu nebo extrahujte DNA pomocí purifikačních souprav.
A-3 Mg2+ koncentrace
——Mg2+ koncentrace je příliš vysoká —— Správně snižte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 dNTP
——Koncentrace dNTP je příliš vysoká —— Vhodně snižte koncentraci dNTP
A-5 Teplota žíhání
—— Příliš nízká teplota žíhání —— Vhodně zvyšte teplotu žíhání
A-6 Cykly
——Příliš mnoho cyklů ——Optimalizujte počet cyklů

Prvním krokem je výběr vhodné polymerázy. Běžná Taq polymeráza nemůže být zkontrolována kvůli nedostatku aktivity 3'-5 'exonukleázy a nesoulad výrazně sníží účinnost extenze fragmentů. Pravidelná Taq polymeráza proto nemůže účinně zesilovat cílové fragmenty větší než 5 kb. Taq polymeráza se speciální modifikací nebo jinou vysoce věrnou polymerázou by měla být zvolena tak, aby se zlepšila účinnost extenze a splnily potřeby amplifikace dlouhým fragmentem. Navíc amplifikace dlouhých fragmentů také vyžaduje odpovídající úpravu designu primerů, denaturační doby, prodlužovací doby, pH pufru atd. Obvykle mohou primery s 18-24 bp vést k lepšímu výtěžku. Aby se zabránilo poškození templátu, měla by být denaturační doba při 94 ° C snížena na 30 sekund nebo méně na cyklus a doba pro zvýšení teploty na 94 ° C před amplifikací by měla být kratší než 1 min. Účinnou amplifikaci dlouhých fragmentů lze navíc zajistit nastavením teploty extenze na přibližně 68 ° C a navržením doby prodloužení podle rychlosti 1 kb/min.
Chybovost PCR amplifikace může být snížena použitím různých DNA polymeráz s vysokou věrností. Ze všech dosud nalezených Taq DNA polymeráz má enzym Pfu nejnižší chybovost a nejvyšší věrnost (viz přiložená tabulka). Kromě výběru enzymů mohou vědci dále snížit rychlost mutace PCR optimalizací reakčních podmínek, včetně optimalizace složení pufru, koncentrace termostabilní polymerázy a optimalizace počtu cyklů PCR.
Kategorie produktů
PROČ NÁS VYBRAT
Od svého založení vyvíjí naše továrna prvotřídní výrobky s dodržováním zásad
nejprve kvality. Naše výrobky získaly vynikající pověst v oboru a důvěryhodnost mezi novými i starými zákazníky.








