Ultra HiFidelity PCR Kit
Funkce
■ Snadná obsluha: Tato sada je dodávána jako 2 × premix a PCR lze provádět jednoduchým přidáním šablon a primerů.
■ Vysoká věrnost: Věrnost je 50krát vyšší než u polymerázy Taq.
■ Vysoká specifičnost: Vynikající výkon při spuštění za účelem zajištění specifičnosti produktu.
■ Rychlé zesílení: Rychlost rozšíření může dosáhnout 10–15 s/kb.
■ Silná rozšiřitelnost: Lze amplifikovat až 20 kb fragmenty DNA.
■ Široká použitelnost: Sada obsahuje PCR Enhancer a je vhodná pro amplifikaci šablon s vysokým GC a komplexů.
Specifikace
Typ: DNA DNA polymeráza s vysokou věrností
Rychlost zesílení: 10-15 s/kb
Velikost fragmentu: <20 kB
Aplikace: High fidelity PCR amplification, gen cloning, high GC template amplification, gen cloning of complex genom, cDNA high fidelity amplification, SNP detection, site-specific mutation, etc.
Výtěžek extrakce DNA z různých rostlinných tkání:
Poznámka: výtěžek DNA závisí na typech vzorků. Všechny výše uvedené materiály pocházejí z jemných listů.
Všechny produkty lze přizpůsobit pro ODM/OEM. Pro detaily,klikněte prosím na přizpůsobenou službu (ODM/OEM)
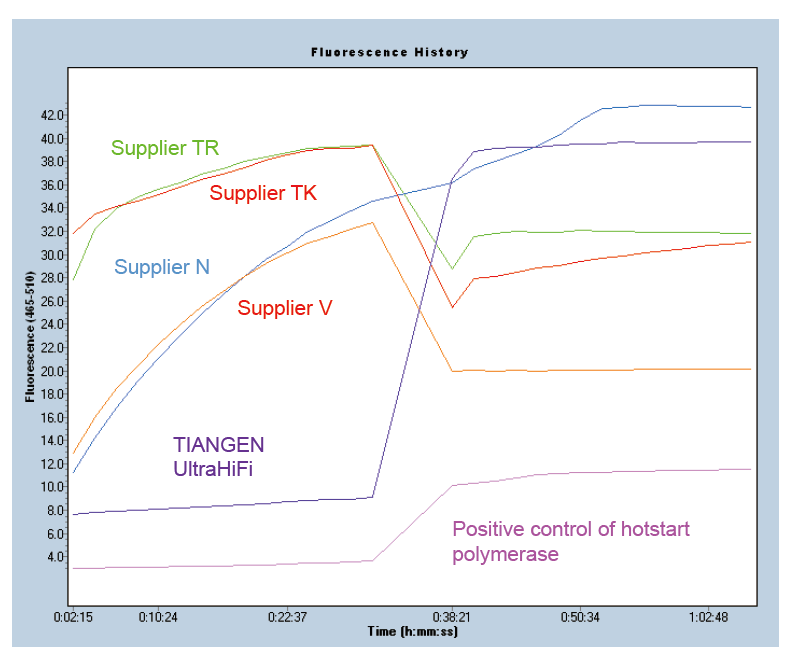 |
Hot-start pro zajištění specifičnosti produktu Obrázek 1. Ultra HiFi má vynikající funkci hot-start, která zajišťuje specifičnost produktů zesílení. Byla použita metoda molekulárních majáků (Ma et al., Anal Biochem, 2006). |
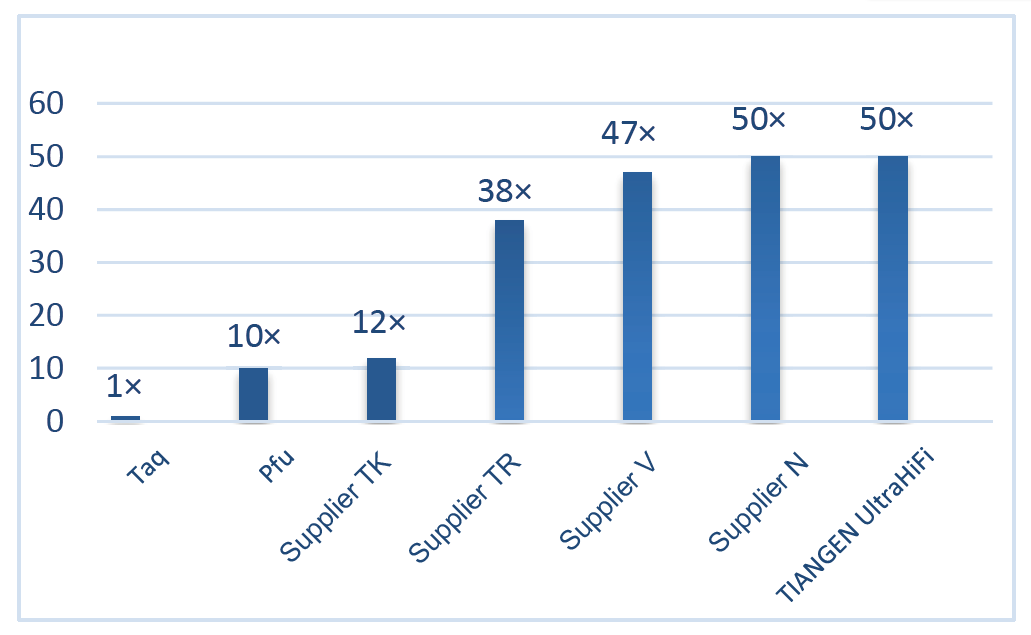 |
Vynikající vysoká věrnost, 50krát vyšší než Taq Polymerase Obrázek 2. Věrnost Ultra HiFi je 50krát vyšší než u běžné polymerázy Taq. Polymerační věrnost Taq polymerázy (bez korekční aktivity) je použita jako referenční. |
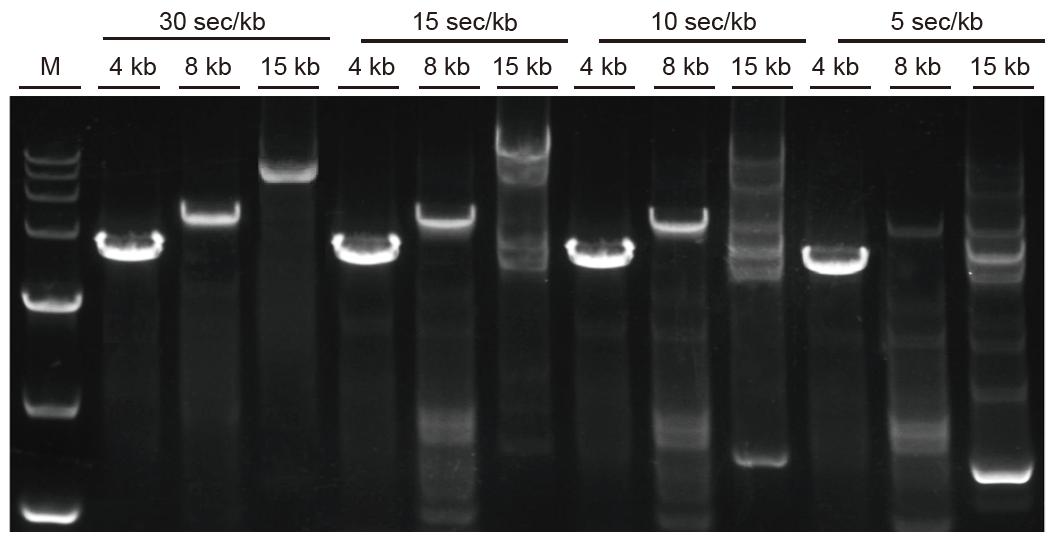 |
Rychlá amplifikace a dlouhé fragmenty mohou být rychle amplifikovány Obr. 3. Ultra HiFi se může rozšířit až na 5 s/kb u fragmentů menších než 4 kb. U dlouhých fragmentů lze dobu amplifikace vhodně prodloužit. U fragmentů větších než 15 kb může být rychlost rozsahu až 30 s/kb. M: Značkovač TIANGEN D15000 |
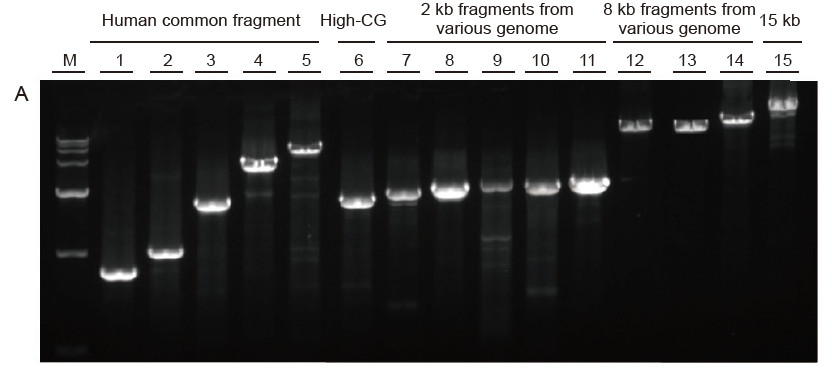 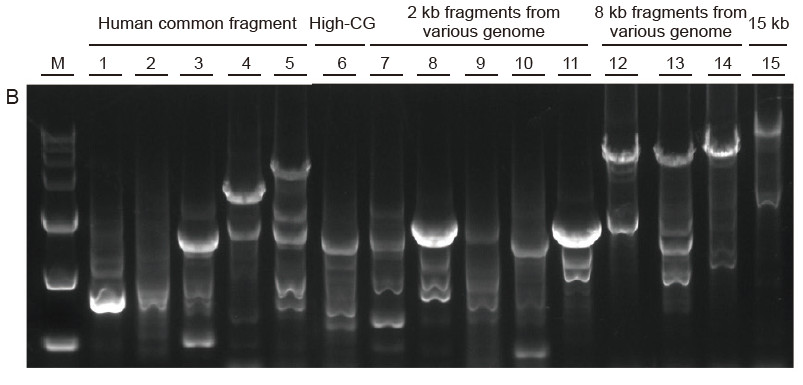 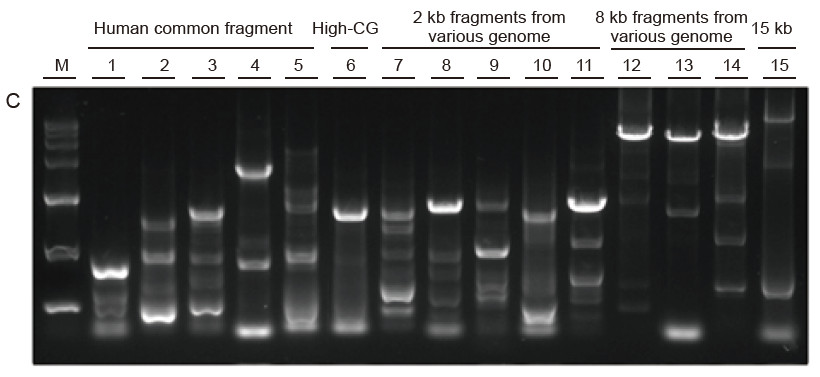 |
Silná univerzálnost a vysoká specifičnost, snadno čitelné vysoké GC a dlouhé fragmenty z různých zdrojů Obrázek 4. Ultra HiFi má vysokou specifičnost zajišťující úspěšnost zesílení a množství produktu pro různé typy šablon. A. Výsledky Hi -Fi zesílení B. Výsledky amplifikace Hi-Fi enzymů dodavatele K C. Výsledky amplifikace Hi-Fi enzymů dodavatele N. M: Značkovač TIANGEN D15000 Dráha 1-5. Výsledky amplifikace šablon s různou délkou: 1, 750 bp; 2. 1 kb; 3. 2 kb; 4,4 kb; 5. 6 kb Dráha 6. Výsledek amplifikace šablony s vysokým GC: 1915 bp (GC%: 70%); Dráha 7-11. Výsledek amplifikace 2 kb šablon z různých genomů: 7. Krysa; 8. Rýže; 9. Pšenice; 10. kukuřice; 11. Bakterie; Dráha 12-14. Výsledek amplifikace 8 kb dlouhého fragmentu: 12. rýže; 13. kukuřice; |
Šablona A-1
■ Šablona obsahuje proteinové nečistoty nebo inhibitory Taq atd. —— Čistěte templát DNA, odstraňte proteinové nečistoty nebo extrahujte templátovou DNA pomocí purifikačních souprav.
■ Denaturace šablony není úplná —— Vhodně zvyšte denaturační teplotu a prodlužte denaturační čas.
■ Degradace šablony —— Připravte šablonu znovu.
Základní nátěr A-2
■ Špatná kvalita primerů-Znovu syntetizujte primer.
■ Degradace primerů —— Alikvotujte primery s vysokou koncentrací do malého objemu pro uchování. Vyvarujte se vícenásobného zmrazení a rozmrazení nebo dlouhodobé kryokonzervované na 4 ° C.
■ Nesprávný design primerů (např. Nedostatečná délka primeru, dimer vytvořený mezi primery atd.) -Přepracovat primery (vyhnout se tvorbě dimeru primeru a sekundární struktury)
A-3 Mg2+koncentrace
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 Teplota žíhání
■ Vysoká teplota žíhání ovlivňuje vazbu primeru a šablony. —— Snižte teplotu žíhání a optimalizujte stav s gradientem 2 ° C.
A-5 Doba prodloužení
■ Krátká doba prodloužení —— Prodlužte dobu prodloužení.
Fenomény: Negativní vzorky také ukazují pásma cílové sekvence.
A-1 Kontaminace PCR
■ Křížová kontaminace cílové sekvence nebo amplifikačních produktů —— Opatrně nepipetujte vzorek obsahující cílovou sekvenci do negativního vzorku ani je nevylijte z centrifugační zkumavky. Činidla nebo zařízení by měla být autoklávována, aby se odstranily stávající nukleové kyseliny, a existence kontaminace by měla být stanovena pomocí experimentů s negativní kontrolou.
■ Kontaminace reagencií ——Realizujte reagencie a skladujte při nízké teplotě.
A-2 Primer
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
■ Nesprávný design primerů a cílová sekvence má homologii s necílovou sekvencí. —— Přepracovat základní nátěry.
Jev: Pásy amplifikace PCR jsou v rozporu s očekávanou velikostí, buď velké nebo malé, nebo se někdy vyskytují jak specifické amplifikační pásy, tak nespecifické amplifikační pásy.
Základní nátěr A-1
■ Špatná specificita primeru
—— Re-design primer.
■ Koncentrace primeru je příliš vysoká —— Správně zvyšte denaturační teplotu a prodlužte denaturační čas.
A-2 Mg2+ koncentrace
■ Mg2+ koncentrace je příliš vysoká —— Správně snižte koncentraci Mg2+: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-3 Termostabilní polymeráza
■ Nadměrné množství enzymu —— Množství enzymu přiměřeně snižte v intervalech 0,5 U.
A-4 Teplota žíhání
■ Teplota žíhání je příliš nízká —— Vhodně zvyšte teplotu žíhání nebo použijte dvoustupňovou metodu žíhání
A-5 PCR cykly
■ Příliš mnoho cyklů PCR — Snižte počet cyklů PCR.
Základní nátěr A-1——Špatná specifičnost ——Předělejte základní nátěr, změňte polohu a délku základního nátěru, abyste zvýšili jeho specifičnost; nebo proveďte vnořenou PCR.
A-2 DNA šablony
——Šablona není čistá —— Purifikujte šablonu nebo extrahujte DNA pomocí purifikačních souprav.
A-3 Mg2+ koncentrace
——Mg2+ koncentrace je příliš vysoká —— Správně snižte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 dNTP
——Koncentrace dNTP je příliš vysoká —— Vhodně snižte koncentraci dNTP
A-5 Teplota žíhání
—— Příliš nízká teplota žíhání —— Vhodně zvyšte teplotu žíhání
A-6 Cykly
——Příliš mnoho cyklů ——Optimalizujte počet cyklů

Prvním krokem je výběr vhodné polymerázy. Běžná Taq polymeráza nemůže být zkontrolována kvůli nedostatku aktivity 3'-5 'exonukleázy a nesoulad výrazně sníží účinnost extenze fragmentů. Pravidelná Taq polymeráza proto nemůže účinně zesilovat cílové fragmenty větší než 5 kb. Taq polymeráza se speciální modifikací nebo jinou vysoce věrnou polymerázou by měla být zvolena tak, aby se zlepšila účinnost extenze a splnily potřeby amplifikace dlouhým fragmentem. Navíc amplifikace dlouhých fragmentů také vyžaduje odpovídající úpravu designu primerů, denaturační doby, prodlužovací doby, pH pufru atd. Obvykle mohou primery s 18-24 bp vést k lepšímu výtěžku. Aby se zabránilo poškození templátu, měla by být denaturační doba při 94 ° C snížena na 30 sekund nebo méně na cyklus a doba pro zvýšení teploty na 94 ° C před amplifikací by měla být kratší než 1 min. Účinnou amplifikaci dlouhých fragmentů lze navíc zajistit nastavením teploty extenze na přibližně 68 ° C a navržením doby prodloužení podle rychlosti 1 kb/min.
Chybovost PCR amplifikace může být snížena použitím různých DNA polymeráz s vysokou věrností. Ze všech dosud nalezených Taq DNA polymeráz má enzym Pfu nejnižší chybovost a nejvyšší věrnost (viz přiložená tabulka). Kromě výběru enzymů mohou vědci dále snížit rychlost mutace PCR optimalizací reakčních podmínek, včetně optimalizace složení pufru, koncentrace termostabilní polymerázy a optimalizace počtu cyklů PCR.
Kategorie produktů
PROČ NÁS VYBRAT
Od svého založení vyvíjí naše továrna prvotřídní výrobky s dodržováním zásad
nejprve kvality. Naše výrobky získaly vynikající pověst v oboru a důvěryhodnost mezi novými i starými zákazníky.