FastKing gDNA Dispelling RT SuperMix
Funkce
■ Rychlý: Jeden krok k dokončení odstranění genomu a efektivní reverzní transkripce do 18 minut přidáním pouze šablon.
■ Vysoká účinnost: Reverzní transkriptáza je modifikována hydrofobním motivem, přičemž účinnost RT přesahuje 95%.
■ Jednoduché a snadné: Exkluzivní termosenzitivní DNáza má rychlý účinek, vysokou účinnost s kratší reakční dobou a neovlivňuje cDNA.
Specifikace
Typ: Genově modifikovaná reverzní transkriptáza, gDNase
Postupy: Jednostupňový (odstranění genomové DNA a RT)
Účinnost RT: > 95%
Šablona: 1 ng- 2 μg
Doba provozu: ~ 18 min
Aplikace: Reverzně transkribovanou cDNA lze použít v konvenčních PCR, real time PCR, konstrukci knihovny cDNA, SAGE (Serial Analysis of Gene Expression), prodloužení primerů a dalších konvenčních experimentech.
Všechny produkty lze přizpůsobit pro ODM/OEM. Pro detaily,klikněte prosím na přizpůsobenou službu (ODM/OEM)
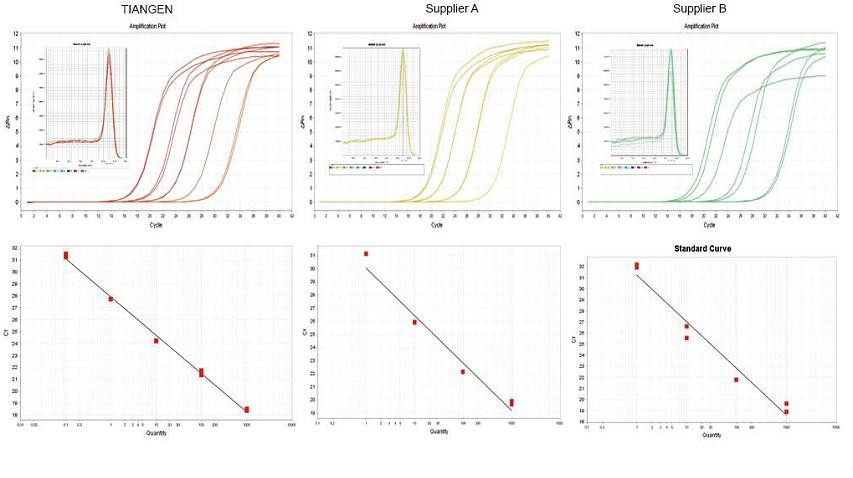 |
Experimentální příklad 1. cDNA byla syntetizována pomocí jednostupňových reverzních kvantitativních reagencií TIANGEN FastKing gDNA Dispelling RT SuperMix, příslušných produktů od dodavatele A a dodavatele B. Detekujte gen RN5 myší pomocí TIANGEN Talent qPCR PreMix (SYBR Green) a analyzovala se amplifikační křivka, křivka tání a standardní křivka. Výsledky ukazují, že TIANGEN FastKing gDNA Dispelling RT SuperMix má nejvyšší kvantitativní hodnotu Ct po reverzní transkripci a vynikající odolnost vůči stresu a má zjevné výhody pro šablony s vysokými zbytky nečistot. |
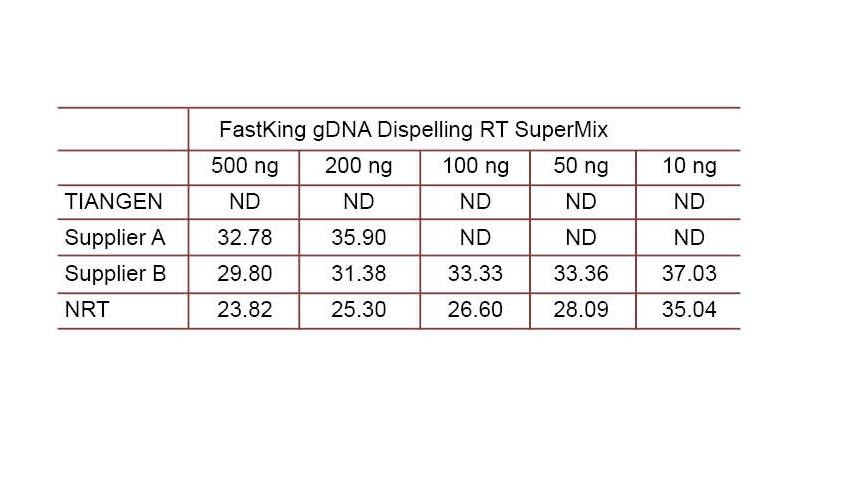 |
Experimentální příklad 2. cDNA byla syntetizována pomocí jednostupňových reverzních kvantitativních reagencií z TIANGEN FastKing gDNA Dispelling RT SuperMix, příslušných produktů od dodavatele A, respektive od dodavatele B. Detekujte lidský gen HsG pomocí TIANGEN Talent qPCR PreMix (SYBR Green) a ručně přidejte různé koncentrace genomové DNA, abyste detekovali schopnost různých činidel odstraňovat gDNA. Výsledky Ct ukazují, že TIANGEN FastKing gDNA Dispelling RT SuperMix má vynikající schopnost odstraňovat genomovou DNA. Bez ovlivnění výsledků lze dokonale odstranit až 500 ng zbytku genomové DNA. ND: Nedetekováno. NRT: Detekce mixu bez reverzní transkripce. |
A-1 RNA je degradována
——Čistěte vysoce kvalitní RNA bez kontaminace. Materiál, ze kterého se extrahuje RNA, by měl být co nejčerstvější, aby se zabránilo degradaci RNA. Před reakcí RT analyzujte integritu RNA na denaturovaném gelu. Po extrakci RNA by měl být skladován ve 100% formamidu. Pokud se použije inhibitor RNázy, teplota zahřívání by měla být <45 ° C a pH by mělo být nižší než 8,0, jinak inhibitor uvolní veškerou navázanou RNázu. Kromě toho by měl být přidán inhibitor RNázy do roztoků obsahujících ≥ 0,8 mM DTT.
A-2 RNA obsahuje inhibitory reakcí reverzní transkripce
—— Mezi inhibitory reverzní transkripce patří SDS, EDTA, glycerol, pyrofosfát sodný, spermidin, formamid, sůl guanidinu atd. Smíchejte kontrolní RNA se vzorkem a porovnejte výtěžek s reakcí kontrolní RNA, abyste zkontrolovali, zda existuje inhibitor. Srážení RNA promyjte 70% (v/v) ethanolem, abyste odstranili inhibitory.
A-3 Nedostatečné žíhání primerů použitých pro syntézu prvního vlákna cDNA
—— Určete, že teplota žíhání je vhodná pro primery použité v experimentu. U náhodných hexamerů se doporučuje udržovat teplotu na 25 ° C po dobu 10 minut před dosažením reakční teploty. U genově specifických primerů (GSP) zkuste jiný GSP nebo přepněte na oligo (dT) nebo náhodný hexamer.
A-4 Malé množství výchozí RNA
—— Zvyšte množství RNA. Pro vzorky RNA menší než 50 ng lze v syntéze cDNA prvního vlákna použít 0,1 μg až 0,5 μg acetyl BSA
A-5 Cílová sekvence není v analyzovaných tkáních exprimována.
——Zkuste jiné tkáně.
A-6 PCR reakce selže
—— U dvoustupňové RT-PCR nesmí cDNA templát v kroku PCR překročit 1/5 reakčního objemu.
A-1 Nespecifické žíhání primerů a šablon
—— 3'-konec primerů by neměl obsahovat 2-3 dG nebo dC. Místo náhodných primerů nebo oligo (dT) použijte v syntéze prvního řetězce genově specifické primery. V prvních cyklech použijte vyšší teplotu žíhání a poté nižší teplotu žíhání. Ke zlepšení specifičnosti reakce použijte pro PCR polymeraci Taq s horkým startem.
A-2 Špatný design genově specifických primerů
—— Při navrhování amplifikačních primerů dodržujte stejné zásady.
A-3 RNA kontaminovaná genomovou DNA
—— Ošetřete RNA DNázou I. stupně PCR. Vytvořte kontrolní reakci bez reverzní transkripce, abyste detekovali kontaminaci DNA.
A-4 Tvoření primeru dimeru
—— Navrhněte primery bez komplementárních sekvencí na 3 'konci.
A-5 Příliš vysoký Mg2+ koncentrace
——Optimize Mg2+ koncentrace pro každou kombinaci templátu a primeru
A-6 Znečištěno cizí DNA
—— Používejte špičky odolné vůči aerosolu a UDG enzymy.
A-1 Obsah produktu z prvního vlákna je příliš vysoký
—— Snižte množství produktu prvního vlákna v konvenčním reakčním kroku PCR.
A-2 Příliš vysoké množství primeru v PCR reakci
—— Snižte vstup primeru.
A-3 Příliš mnoho cyklů
—— Optimalizujte podmínky reakce PCR a snižte počet cyklů PCR.
A-4 Příliš nízká teplota žíhání
——Zvýšení teploty žíhání, aby se zabránilo nespecifické iniciaci a prodloužení.
A-5 Nespecifická amplifikace oligonukleotidových fragmentů generovaných degradací DNA DNázou —— Extrahujte vysoce kvalitní RNA, abyste zabránili kontaminaci DNA.
RT-PCR má reverzně transkribovat RNA do cDNA a poté použít reverzně transkribovanou cDNA jako templát pro PCR reakci pro amplifikaci cílového fragmentu. Vyberte buď náhodné primery, Oligo dT a genově specifické primery podle konkrétních podmínek experimentu. Všechny výše uvedené primery lze použít pro krátkou eukaryotickou buněčnou mRNA bez struktury vlásenky.
Náhodný primer: Vhodný pro dlouhou RNA se strukturou vlásenky, stejně jako pro všechny druhy RNA, jako je rRNA, mRNA, tRNA atd. Používají se hlavně pro RT-PCR reakci jednoho templátu.
Oligo dT: Vhodný pro RNA s PolyA ocasem (prokaryotická RNA, eukaryotická Oligo dT rRNA a tRNA nemají PolyA konce). Protože je Oligo dT vázán na ocas PolyA, vyžaduje se, aby kvalita vzorků RNA byla vysoká, a dokonce i malé množství degradace výrazně sníží množství syntézy cDNA v plné délce.
Genově specifický primer: Komplementární k sekvenci templátu, vhodný pro situace, kde je známá cílová sekvence.
Existují dva způsoby:
1. Interní referenční metoda: cDNA jsou teoreticky fragmenty DNA různé délky, takže výsledkem elektroforézy je rozmazání. Pokud je množství RNA nízké, žádný produkt se při elektroforéze neukáže, ale to neznamená, že žádný produkt nebude amplifikován pomocí PCR. K detekci cDNA lze obecně použít interní referenci. Pokud má interní reference výsledky, lze kvalitu cDNA v zásadě zaručit (v několika případech, pokud je fragment cílového genu příliš dlouhý, mohou existovat výjimky).
2. Pokud existuje známý gen zesílený touto šablonou, lze jej ověřit primery tohoto genu. Zesílení vnitřní reference nemusí nutně znamenat, že s cDNA není problém. Protože interní reference má v cDNA vysoký výskyt, je snadné ji zesílit. Pokud je cDNA částečně degradována z různých důvodů, z hlediska pravděpodobnosti budou výsledky PCR cílových genů s nízkou četností výrazně ovlivněny. I když je vnitřní reference stále hojná, amplifikace pravděpodobně nebude ovlivněna.
Částečně degraduje RNA. Zjistěte integritu a vyčistěte RNA
Obsahy RNA různých druhů mohou být různé, ale obecně by extrahovaná celková RNA měla obsahovat dva čiré pásy 28S a 18S v gelové elektroforéze a jas prvního pásu by měl být dvakrát vyšší než u druhého. Pás 5S ukazuje, že RNA byla degradována a její jas je úměrný stupni degradace. Úspěšná amplifikace vnitřní reference neznamená, že není problém s RNA, protože vnitřní reference je ve velkém množství, RNA může být amplifikována, pokud degradace není závažná. OD260/OD280poměr čisté RNA měřený spektrofotometrem by měl být mezi 1,9 a 2,1. Malé množství proteinových nečistot v RNA poměr sníží. Dokud hodnota není příliš nízká, RT nebude ovlivněna. Pro RT je nejdůležitější integrita RNA.
Rozšíření interního referenčního genu může pouze naznačovat, že RT uspěl, ale nemusí nutně souviset s kvalitou řetězce cDNA. Protože jsou vnitřní referenční fragmenty obecně malé velikosti a mají vysokou expresi, je snazší uspět v reverzní transkripci. Velikost a exprese cílového genu se však liší gen od genu. Kvalitu cDNA nelze posoudit pouze interní referencí, zejména pro cílové fragmenty delší než 2 kb.
Některé vzorky mají složité sekundární struktury nebo mají bohatý obsah GC nebo jsou vzácné s malým výskytem. V těchto případech by měla být zvolena vhodná reverzní transkriptáza podle velikosti cílového fragmentu a vzorku. U templátů RNA s vysokým obsahem GC a komplexní sekundární strukturou je obtížné otevřít sekundární strukturu při nízké teplotě nebo pomocí běžné reverzní transkriptázy. Pro tyto templáty lze zvolit kvantovou reverzní transkriptázu, protože její reverzní transkripční výkon je zjevně lepší než u reverzní transkriptázy řady M-MLV, která dokáže účinně reverzně transkribovat různé templáty RNA a v maximální míře transkribovat RNA do prvního vlákna cDNA. Při použití obecné soupravy pro reverzní transkriptázu může 20 μl systém účinně reverzně přepsat pouze 1 μg celkové RNA. Věnujte prosím pozornost maximální kapacitě RT soupravy. Pokud je templát přidán v přebytku, reverzní transkripce zvýhodní RNA s vysokým výskytem. Proto je lepší nepřekračovat maximální kapacitu systému.
A-1 Určete, zda je RNA vážně degradována a zda je RT úspěšná
Obecně je důvod selhání interní referenční amplifikace často způsoben vážnou degradací RNA. Dalším možným důvodem je selhání reverzní transkripce. Interní referenci nelze použít jako standard k posouzení kvality jednoho vlákna cDNA, ale lze jej použít jako standard k posouzení, zda je reverzní transkripce úspěšná, pokud není problém s kvalitou RNA. Nejdůležitější věcí v procesu reverzní transkripce je udržovat konstantní teplotu a konstantní reakční systém, aby se zlepšila účinnost reakce.
A-2 Určete, zda jsou primery pro amplifikaci interních referenčních genů spolehlivé a zda existují problémy s činidly používanými v PCR.
Pro relativní kvantifikaci musí být RNA kvantifikována před reverzní transkripcí, což je také vyžadováno v mnoha soupravách pro reverzní transkripci, například kvantifikujte vstup RNA jako 1 μg. Protože reverzně transkribovaná cDNA je smíšený roztok, včetně RNA, oligo dT, enzymu, dNTP a dokonce i malého zbytku DNA, bude způsobena odchylka, takže není možné přesně kvantifikovat cDNA. Proto je nutná kvantifikace RNA. Vzhledem k tomu, že účinnost reverzní transkripce je u různých vzorků stejná, mělo by být množství získané cDNA stejné a kvantitativní analýza může ukázat srovnání úrovní exprese různých genů se stejným množstvím celkové RNA. Při provádění relativní fluorescenční kvantitativní PCR nemusí být kvantitativní cDNA po reverzní transkripci vyžadována, protože vnitřní referenční gen může fungovat jako referenční.
Je to hlavně v souvislosti s geny a reverzní transkripce dlouhého fragmentu není pro většinu genů proveditelná. Za prvé, účinnost reverzní transkripce je mnohem nižší než u PCR. Za druhé, oblast bohatá na GC a sekundární struktura mnoha genů omezují jak reverzní transkripci, tak PCR. Konečně, věrnost a účinnost amplifikace PCR je obtížné současně zaručit. V procesu reverzní transkripce nikdo nemůže zaručit získání dlouhého fragmentu pro geny s nízkou kopií, zejména s použitím oligo dT. Pokud jde o 5 'UTR s více GC, je to ještě obtížnější. Proto je stále rozumnou metodou reverzní transkript s náhodnými primery, nalezení přirozených štěpných míst v cílovém fragmentu, amplifikace segmenty a poté provedení restrikčního štěpení a ligace. Obecně je obtížné přímo amplifikovat fragmenty větší než 2 kb, ale není vždy nemožné získat: 1. Za prvé, zaručit integritu RNA/mRNA a preferována je extrakce TRIZOL. 2. Soupravu M-MLV RT-PCR lze použít přímo. Správně prodlužte dobu žíhání a zvyšte počet cyklů v procesu amplifikace. Alternativně lze vnořenou PCR použít nebo provést jednu nebo dvě reakce nejprve s příslušně prodlouženou denaturací a prodlužovací dobou před normální amplifikací PCR, což může pomoci rozšířit fragmenty. Věnujte pozornost věrnosti polymerázy. 3. Long Taq lze použít v PCR k získání ideálních výsledků. 4. Pro aplikaci exprese proteinů by měla být použita vysoce přesná polymeráza.
TIANGEN nabízí dva druhy reverzní transkriptázy: Quant/King RTase a TIANScript M-MLV. Hlavní rozdíl mezi nimi je vstupní množství šablon. Quant je unikátní reverzní transkriptáza, která se liší od běžně používaného M-MLV odvozeného z viru myší leukémie Moloney. Quant je nová vysoce účinná reverzní transkriptáza rekombinantně exprimovaná inženýrstvím Escherichia coli. Quant je vhodný pro amplifikaci 50 ng-2 μg RNA s vysokou reverzní transkripční aktivitou a vysokým výtěžkem. Ve srovnání s běžným MMLV nebo AMV je Quantovou největší charakteristikou to, že má velmi silnou afinitu k RNA templátům a může reverzovat transkriptové komplexní templáty bez denaturace při vysoké teplotě. U šablon s vyšším obsahem GC je reverzní účinnost vyšší. Tato reverzní transkriptáza má však aktivitu RNázy H, která může ovlivnit délku produktu cDNA (vhodné pro templáty <4,5 kb). Pro konvenční reverzní transkripci se doporučuje reverzní transkriptáza TIANScript MMLV. Tato RTáza je modifikovaný enzym s velmi slabou aktivitou RNázy H, který je vhodný pro dlouhou (> 5 kb) syntézu cDNA.
Jednostupňová reverzní transkripce a PCR amplifikace jsou dokončeny ve stejné zkumavce bez otevření krytu zkumavky mezi syntézou cDNA a amplifikací, což pomáhá snížit kontaminaci. Protože všechny získané vzorky cDNA jsou použity k amplifikaci, citlivost je vyšší, s minimem 0,01 pg celkové RNA. Pro úspěšný jednostupňový RTPCR se pro zahájení syntézy cDNA obecně používají genově specifické primery. Dvoukroková metoda, konkrétně reverzní transkripce a PCR amplifikace, se provádí ve dvou krocích. Nejprve se provede reverzní transkripce z RNA templátu k získání cDNA a získaná cDNA se podrobí jedné nebo více různým reakcím PCR. Dvoukroková metoda může použít oligo (dT) nebo náhodné primery k vedení syntézy prvního vlákna cDNA a může reverzně transkribovat všechny informace o mRNA ze specifického vzorku.
Kategorie produktů
PROČ NÁS VYBRAT
Od svého založení vyvíjí naše továrna prvotřídní výrobky s dodržováním zásad
nejprve kvality. Naše výrobky získaly vynikající pověst v oboru a důvěryhodnost mezi novými i starými zákazníky.