Sada FastKing RT (s gDNase)
Funkce
■ Vysoká účinnost: FastKing RT Enzyme je upraven s hydrofobním motivem, s účinností RT více než 95%.
■ Citlivé: Šablony 1 ng lze přesně identifikovat.
■ Odolnost: Možnost reverzní transkripce komplexních šablon, s dokonalou odolností vůči nečistotám.
■ Flexibilní: Odstranění genomové DNA a reverzní transkripce byly dokončeny samostatně. Primery byly smíchány odděleně ve zkumavce, flexibilně za účelem změny ostatních primerů.
Specifikace
Typ: Genem modifikovaná reverzní transkriptáza, gDNase
Postupy: Dvoufázové (odstranění genomové DNA a RT)
Účinnost RT:> 95%
Šablona: 1 ng- 2 μg
Doba provozu: ~ 21 min
Aplikace: reverzně transkribovaná cDNA může být použita při konvenční PCR, real time PCR, konstrukci cDNA knihovny.
21 minut reakce v jedné zkumavce
Dokončení odstranění gDNA a efektivního procesu reverzní transkripce ve stejné zkumavce trvá pouze 21 minut, aniž by byla nahrazena reakční zkumavka a nezávislý proces zpracování DNase I. Ve srovnání s tradiční metodou, která vyžaduje 12krokový provoz a 140minutovou reakci, výrazně zjednodušuje pracovní kroky a šetří spoustu času.
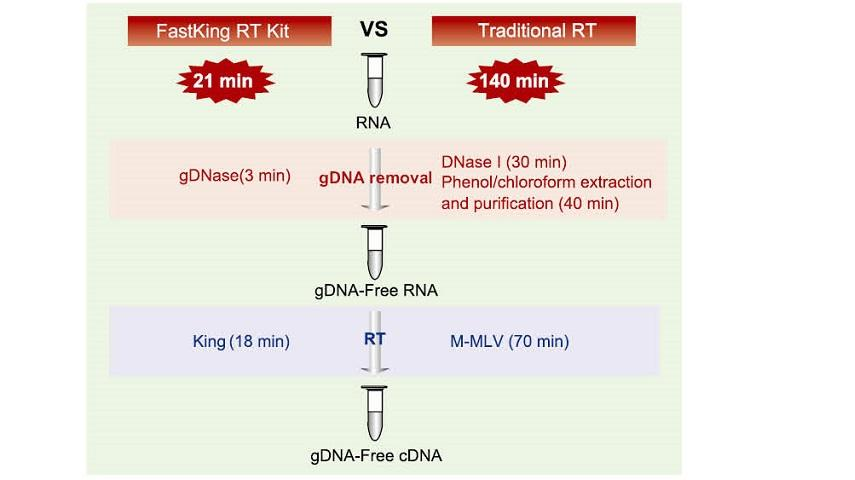
Vynikající kvalita King RTase
—— Extrémně vysoká účinnost reverzní transkripce
—— Účinnost reverzní transkripce je více než 95%
Obecná reverzní transkriptáza má účinnost reverzní transkripce 40-60%a výtěžek cDNA lze zvýšit vyšším množstvím RNA. Králová reverzní transkriptáza může dosáhnout reverzní transkripční účinnosti více než 95% díky své jedinečné vysoké afinitě k RNA templátům. Následné experimenty lze tedy uspokojit bez potřeby velkého množství vstupu RNA, což šetří RNA a umožňuje vysokou čistotu a vysoký výtěžek cDNA.
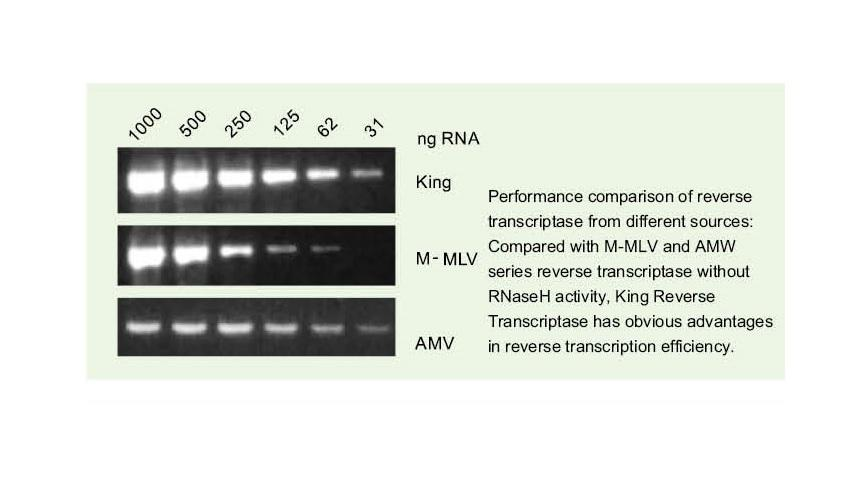
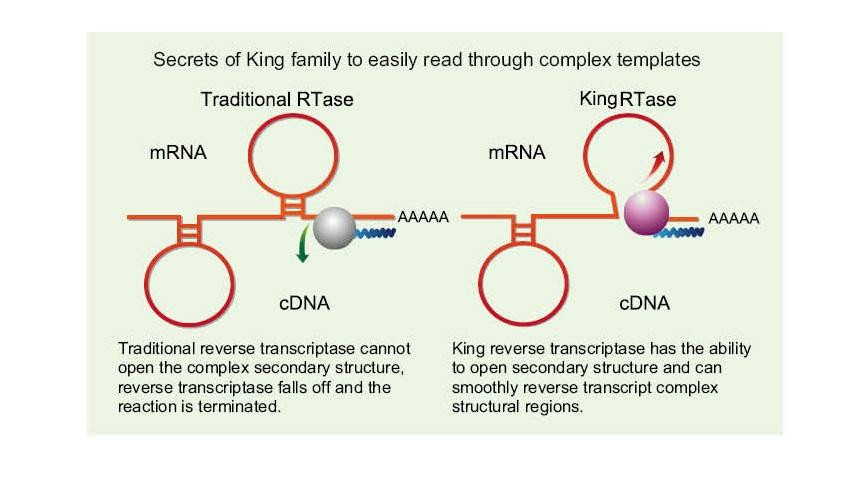
Snadno si přečtěte složité šablony
——Snadno si přečtěte šablony s vysokým GC a složité šablony
Jednovláknová RNA má širokou škálu komplexních oblastí sekundární struktury díky vodíkovým vazbám mezi vlákny. Běžná reverzní transkriptáza může vést k ukončení reverzní transkripce, když narazí na složitou sekundární strukturu, takže nemůže úspěšně dokončit syntézu cDNA. Nová generace Kingovy reverzní transkriptázy má však jedinečnou strukturní doménu, která může zničit vodíkovou vazbu mezi vlákny RNA, čímž se otevře komplexní sekundární struktura RNA a zajistí hladká reverzní transkripce.
Všechny produkty lze přizpůsobit pro ODM/OEM. Pro detaily,klikněte prosím na přizpůsobenou službu (ODM/OEM)
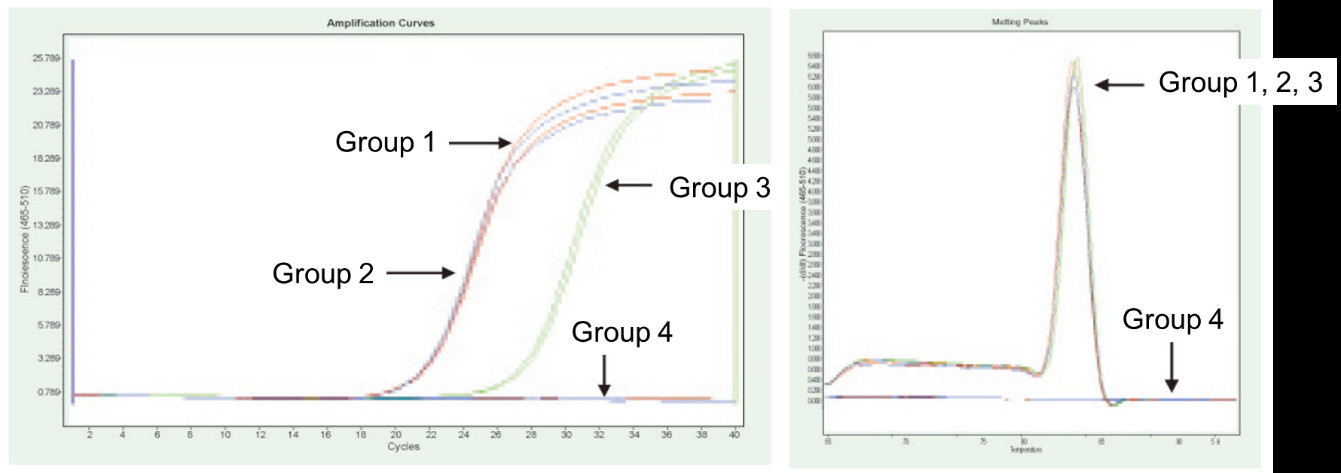 |
Skupina 1: Reverzní transkripce bez léčby gDNázou; Skupina 2: Žádné ošetření gDNázou a žádná reverzní transkripce; Skupina 3: Reverzní transkripce po ošetření gDNázou; Skupina 4: Léčba gDNázou bez reverzní transkripce. Metody: Fluorescenční kvantitativní PCR detekce genu TNF-alfa (primer navržený na exonu s cDNA nebo genomem jako templátem) za použití 1 μg RNA buňky Hela (se zbytkem genomu) jako šablony. Výsledky: Jak je znázorněno na obrázku, skupina 2 může odrážet zbytek genomu v RNA, skupina 3 může přesně odrážet skutečnou úroveň exprese TNF-alfa, skupina 1 má chyby v konečných kvantitativních výsledcích kvůli zbytku genomu a skupina 4 ukazuje, že sada FastKing RT Kit dokáže zcela odstranit zbytkovou genomovou DNA v RNA. |
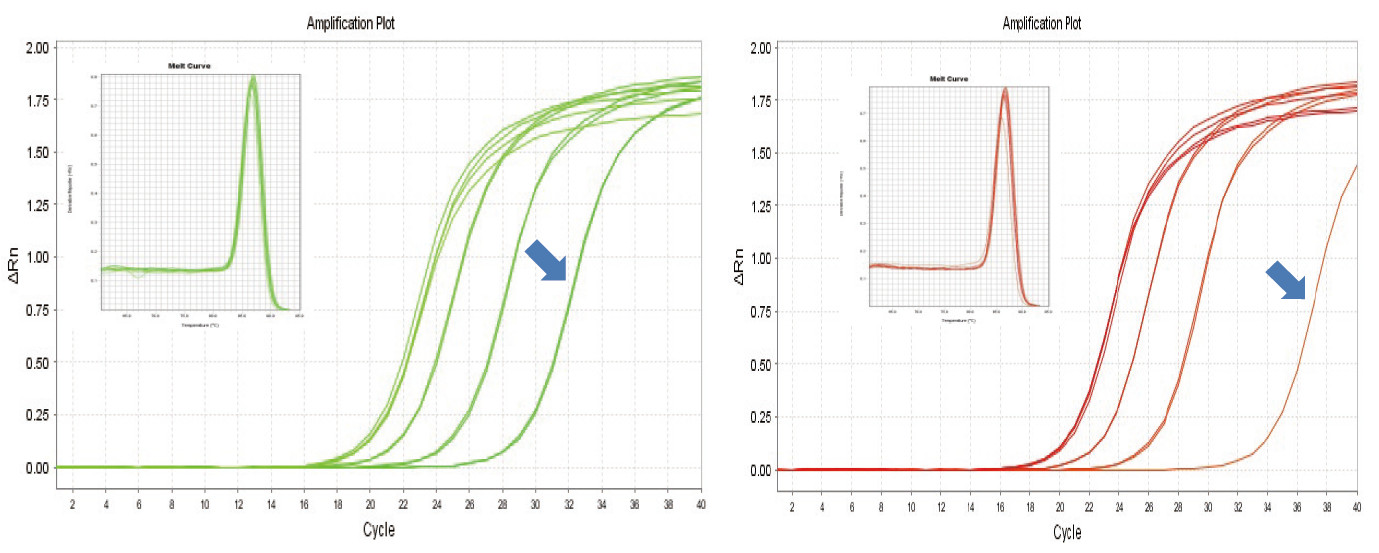 |
Obrázek 1. Reverzní transkripce myší RNA byla provedena pomocí soupravy TIANGEN FastKing RT Kit (vlevo) a příslušného produktu dodavatele A (vpravo), poté byl gen MM5 kvantitativně amplifikován pomocí TIANGEN SuperReal PreMix Plus (SYBR Green). Byla analyzována amplifikační křivka a křivka tání. Vstup RNA byl 1 000 ng, 100 ng, 10 ng a 1 ng. Výsledky ukazují, že sada TIANGEN FastKing RT Kit má jasný gradient reverzní transkripce a nízkou hodnotu Ct a má zjevné výhody pro reverzní transkripci šablony s nízkou četností (1 ng, modrá šipka). |
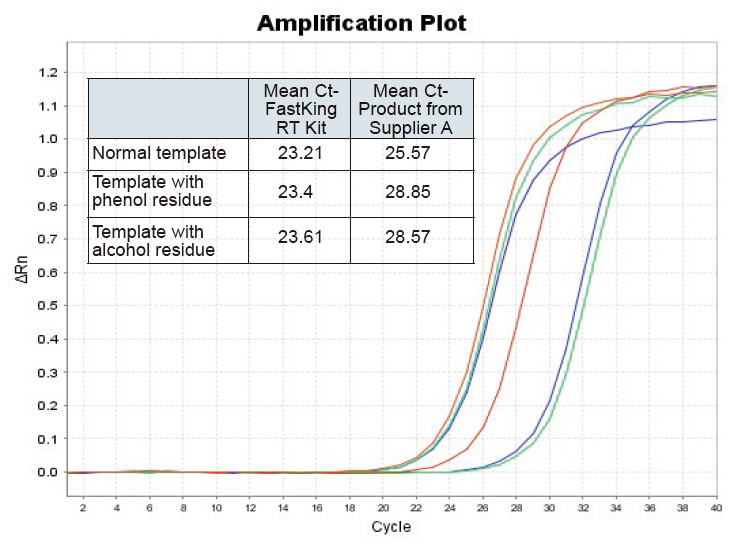 |
Obrázek 2. Reverzní transkripce normální RNA šablony (červená), templátu s velkým fenolovým zbytkem (zelená) a šablony s alkoholovým zbytkem (modrá) krys pomocí soupravy TIANGEN FastKing RT a příslušného produktu dodavatele A, v tomto pořadí, kvantifikujte geny RNC pomocí TIANGEN SuperReal Byly analyzovány PreMix Plus (SYBR Green) a amplifikační křivky a hodnoty Ct. Výsledky ukazují, že TIANGEN FastKing RT Kit má nejnižší kvantitativní hodnotu Ct po reverzní transkripci a vynikající odolnost vůči stresu a má zjevné výhody pro šablony s vysokými zbytky nečistot |
A-1 RNA je degradována
——Čistěte vysoce kvalitní RNA bez kontaminace. Materiál, ze kterého se extrahuje RNA, by měl být co nejčerstvější, aby se zabránilo degradaci RNA. Před reakcí RT analyzujte integritu RNA na denaturovaném gelu. Po extrakci RNA by měl být skladován ve 100% formamidu. Pokud se použije inhibitor RNázy, teplota zahřívání by měla být <45 ° C a pH by mělo být nižší než 8,0, jinak inhibitor uvolní veškerou navázanou RNázu. Kromě toho by měl být přidán inhibitor RNázy do roztoků obsahujících ≥ 0,8 mM DTT.
A-2 RNA obsahuje inhibitory reakcí reverzní transkripce
—— Mezi inhibitory reverzní transkripce patří SDS, EDTA, glycerol, pyrofosfát sodný, spermidin, formamid, sůl guanidinu atd. Smíchejte kontrolní RNA se vzorkem a porovnejte výtěžek s reakcí kontrolní RNA, abyste zkontrolovali, zda existuje inhibitor. Srážení RNA promyjte 70% (v/v) ethanolem, abyste odstranili inhibitory.
A-3 Nedostatečné žíhání primerů použitých pro syntézu prvního vlákna cDNA
—— Určete, že teplota žíhání je vhodná pro primery použité v experimentu. U náhodných hexamerů se doporučuje udržovat teplotu na 25 ° C po dobu 10 minut před dosažením reakční teploty. U genově specifických primerů (GSP) zkuste jiný GSP nebo přepněte na oligo (dT) nebo náhodný hexamer.
A-4 Malé množství výchozí RNA
—— Zvyšte množství RNA. Pro vzorky RNA menší než 50 ng lze v syntéze cDNA prvního vlákna použít 0,1 μg až 0,5 μg acetyl BSA
A-5 Cílová sekvence není v analyzovaných tkáních exprimována.
——Zkuste jiné tkáně.
A-6 PCR reakce selže
—— U dvoustupňové RT-PCR nesmí cDNA templát v kroku PCR překročit 1/5 reakčního objemu.
A-1 Nespecifické žíhání primerů a šablon
—— 3'-konec primerů by neměl obsahovat 2-3 dG nebo dC. Místo náhodných primerů nebo oligo (dT) použijte v syntéze prvního řetězce genově specifické primery. V prvních cyklech použijte vyšší teplotu žíhání a poté nižší teplotu žíhání. Ke zlepšení specifičnosti reakce použijte pro PCR polymeraci Taq s horkým startem.
A-2 Špatný design genově specifických primerů
—— Při navrhování amplifikačních primerů dodržujte stejné zásady.
A-3 RNA kontaminovaná genomovou DNA
—— Ošetřete RNA DNázou I. stupně PCR. Vytvořte kontrolní reakci bez reverzní transkripce, abyste detekovali kontaminaci DNA.
A-4 Tvoření primeru dimeru
—— Navrhněte primery bez komplementárních sekvencí na 3 'konci.
A-5 Příliš vysoký Mg2+ koncentrace
——Optimize Mg2+ koncentrace pro každou kombinaci templátu a primeru
A-6 Znečištěno cizí DNA
—— Používejte špičky odolné vůči aerosolu a UDG enzymy.
A-1 Obsah produktu z prvního vlákna je příliš vysoký
—— Snižte množství produktu prvního vlákna v konvenčním reakčním kroku PCR.
A-2 Příliš vysoké množství primeru v PCR reakci
—— Snižte vstup primeru.
A-3 Příliš mnoho cyklů
—— Optimalizujte podmínky reakce PCR a snižte počet cyklů PCR.
A-4 Příliš nízká teplota žíhání
——Zvýšení teploty žíhání, aby se zabránilo nespecifické iniciaci a prodloužení.
A-5 Nespecifická amplifikace oligonukleotidových fragmentů generovaných degradací DNA DNázou —— Extrahujte vysoce kvalitní RNA, abyste zabránili kontaminaci DNA.
RT-PCR má reverzně transkribovat RNA do cDNA a poté použít reverzně transkribovanou cDNA jako templát pro PCR reakci pro amplifikaci cílového fragmentu. Vyberte buď náhodné primery, Oligo dT a genově specifické primery podle konkrétních podmínek experimentu. Všechny výše uvedené primery lze použít pro krátkou eukaryotickou buněčnou mRNA bez struktury vlásenky.
Náhodný primer: Vhodný pro dlouhou RNA se strukturou vlásenky, stejně jako pro všechny druhy RNA, jako je rRNA, mRNA, tRNA atd. Používají se hlavně pro RT-PCR reakci jednoho templátu.
Oligo dT: Vhodný pro RNA s PolyA ocasem (prokaryotická RNA, eukaryotická Oligo dT rRNA a tRNA nemají PolyA konce). Protože je Oligo dT vázán na ocas PolyA, vyžaduje se, aby kvalita vzorků RNA byla vysoká, a dokonce i malé množství degradace výrazně sníží množství syntézy cDNA v plné délce.
Genově specifický primer: Komplementární k sekvenci templátu, vhodný pro situace, kde je známá cílová sekvence.
Existují dva způsoby:
1. Interní referenční metoda: cDNA jsou teoreticky fragmenty DNA různé délky, takže výsledkem elektroforézy je rozmazání. Pokud je množství RNA nízké, žádný produkt se při elektroforéze neukáže, ale to neznamená, že žádný produkt nebude amplifikován pomocí PCR. K detekci cDNA lze obecně použít interní referenci. Pokud má interní reference výsledky, lze kvalitu cDNA v zásadě zaručit (v několika případech, pokud je fragment cílového genu příliš dlouhý, mohou existovat výjimky).
2. Pokud existuje známý gen zesílený touto šablonou, lze jej ověřit primery tohoto genu. Zesílení vnitřní reference nemusí nutně znamenat, že s cDNA není problém. Protože interní reference má v cDNA vysoký výskyt, je snadné ji zesílit. Pokud je cDNA částečně degradována z různých důvodů, z hlediska pravděpodobnosti budou výsledky PCR cílových genů s nízkou četností výrazně ovlivněny. I když je vnitřní reference stále hojná, amplifikace pravděpodobně nebude ovlivněna.
Částečně degraduje RNA. Zjistěte integritu a vyčistěte RNA
Obsahy RNA různých druhů mohou být různé, ale obecně by extrahovaná celková RNA měla obsahovat dva čiré pásy 28S a 18S v gelové elektroforéze a jas prvního pásu by měl být dvakrát vyšší než u druhého. Pás 5S ukazuje, že RNA byla degradována a její jas je úměrný stupni degradace. Úspěšná amplifikace vnitřní reference neznamená, že není problém s RNA, protože vnitřní reference je ve velkém množství, RNA může být amplifikována, pokud degradace není závažná. OD260/OD280poměr čisté RNA měřený spektrofotometrem by měl být mezi 1,9 a 2,1. Malé množství proteinových nečistot v RNA poměr sníží. Dokud hodnota není příliš nízká, RT nebude ovlivněna. Pro RT je nejdůležitější integrita RNA.
Rozšíření interního referenčního genu může pouze naznačovat, že RT uspěl, ale nemusí nutně souviset s kvalitou řetězce cDNA. Protože jsou vnitřní referenční fragmenty obecně malé velikosti a mají vysokou expresi, je snazší uspět v reverzní transkripci. Velikost a exprese cílového genu se však liší gen od genu. Kvalitu cDNA nelze posoudit pouze interní referencí, zejména pro cílové fragmenty delší než 2 kb.
Některé vzorky mají složité sekundární struktury nebo mají bohatý obsah GC nebo jsou vzácné s malým výskytem. V těchto případech by měla být zvolena vhodná reverzní transkriptáza podle velikosti cílového fragmentu a vzorku. U templátů RNA s vysokým obsahem GC a komplexní sekundární strukturou je obtížné otevřít sekundární strukturu při nízké teplotě nebo pomocí běžné reverzní transkriptázy. Pro tyto templáty lze zvolit kvantovou reverzní transkriptázu, protože její reverzní transkripční výkon je zjevně lepší než u reverzní transkriptázy řady M-MLV, která dokáže účinně reverzně transkribovat různé templáty RNA a v maximální míře transkribovat RNA do prvního vlákna cDNA. Při použití obecné soupravy pro reverzní transkriptázu může 20 μl systém účinně reverzně přepsat pouze 1 μg celkové RNA. Věnujte prosím pozornost maximální kapacitě RT soupravy. Pokud je templát přidán v přebytku, reverzní transkripce zvýhodní RNA s vysokým výskytem. Proto je lepší nepřekračovat maximální kapacitu systému.
A-1 Určete, zda je RNA vážně degradována a zda je RT úspěšná
Obecně je důvod selhání interní referenční amplifikace často způsoben vážnou degradací RNA. Dalším možným důvodem je selhání reverzní transkripce. Interní referenci nelze použít jako standard k posouzení kvality jednoho vlákna cDNA, ale lze jej použít jako standard k posouzení, zda je reverzní transkripce úspěšná, pokud není problém s kvalitou RNA. Nejdůležitější věcí v procesu reverzní transkripce je udržovat konstantní teplotu a konstantní reakční systém, aby se zlepšila účinnost reakce.
A-2 Určete, zda jsou primery pro amplifikaci interních referenčních genů spolehlivé a zda existují problémy s činidly používanými v PCR.
Pro relativní kvantifikaci musí být RNA kvantifikována před reverzní transkripcí, což je také vyžadováno v mnoha soupravách pro reverzní transkripci, například kvantifikujte vstup RNA jako 1 μg. Protože reverzně transkribovaná cDNA je smíšený roztok, včetně RNA, oligo dT, enzymu, dNTP a dokonce i malého zbytku DNA, bude způsobena odchylka, takže není možné přesně kvantifikovat cDNA. Proto je nutná kvantifikace RNA. Vzhledem k tomu, že účinnost reverzní transkripce je u různých vzorků stejná, mělo by být množství získané cDNA stejné a kvantitativní analýza může ukázat srovnání úrovní exprese různých genů se stejným množstvím celkové RNA. Při provádění relativní fluorescenční kvantitativní PCR nemusí být kvantitativní cDNA po reverzní transkripci vyžadována, protože vnitřní referenční gen může fungovat jako referenční.
Je to hlavně v souvislosti s geny a reverzní transkripce dlouhého fragmentu není pro většinu genů proveditelná. Za prvé, účinnost reverzní transkripce je mnohem nižší než u PCR. Za druhé, oblast bohatá na GC a sekundární struktura mnoha genů omezují jak reverzní transkripci, tak PCR. Konečně, věrnost a účinnost amplifikace PCR je obtížné současně zaručit. V procesu reverzní transkripce nikdo nemůže zaručit získání dlouhého fragmentu pro geny s nízkou kopií, zejména s použitím oligo dT. Pokud jde o 5 'UTR s více GC, je to ještě obtížnější. Proto je stále rozumnou metodou reverzní transkript s náhodnými primery, nalezení přirozených štěpných míst v cílovém fragmentu, amplifikace segmenty a poté provedení restrikčního štěpení a ligace. Obecně je obtížné přímo amplifikovat fragmenty větší než 2 kb, ale není vždy nemožné získat: 1. Za prvé, zaručit integritu RNA/mRNA a preferována je extrakce TRIZOL. 2. Soupravu M-MLV RT-PCR lze použít přímo. Správně prodlužte dobu žíhání a zvyšte počet cyklů v procesu amplifikace. Alternativně lze vnořenou PCR použít nebo provést jednu nebo dvě reakce nejprve s příslušně prodlouženou denaturací a prodlužovací dobou před normální amplifikací PCR, což může pomoci rozšířit fragmenty. Věnujte pozornost věrnosti polymerázy. 3. Long Taq lze použít v PCR k získání ideálních výsledků. 4. Pro aplikaci exprese proteinů by měla být použita vysoce přesná polymeráza.
TIANGEN nabízí dva druhy reverzní transkriptázy: Quant/King RTase a TIANScript M-MLV. Hlavní rozdíl mezi nimi je vstupní množství šablon. Quant je unikátní reverzní transkriptáza, která se liší od běžně používaného M-MLV odvozeného z viru myší leukémie Moloney. Quant je nová vysoce účinná reverzní transkriptáza rekombinantně exprimovaná inženýrstvím Escherichia coli. Quant je vhodný pro amplifikaci 50 ng-2 μg RNA s vysokou reverzní transkripční aktivitou a vysokým výtěžkem. Ve srovnání s běžným MMLV nebo AMV je Quantovou největší charakteristikou to, že má velmi silnou afinitu k RNA templátům a může reverzovat transkriptové komplexní templáty bez denaturace při vysoké teplotě. U šablon s vyšším obsahem GC je reverzní účinnost vyšší. Tato reverzní transkriptáza má však aktivitu RNázy H, která může ovlivnit délku produktu cDNA (vhodné pro templáty <4,5 kb). Pro konvenční reverzní transkripci se doporučuje reverzní transkriptáza TIANScript MMLV. Tato RTáza je modifikovaný enzym s velmi slabou aktivitou RNázy H, který je vhodný pro dlouhou (> 5 kb) syntézu cDNA.
Jednostupňová reverzní transkripce a PCR amplifikace jsou dokončeny ve stejné zkumavce bez otevření krytu zkumavky mezi syntézou cDNA a amplifikací, což pomáhá snížit kontaminaci. Protože všechny získané vzorky cDNA jsou použity k amplifikaci, citlivost je vyšší, s minimem 0,01 pg celkové RNA. Pro úspěšný jednostupňový RTPCR se pro zahájení syntézy cDNA obecně používají genově specifické primery. Dvoukroková metoda, konkrétně reverzní transkripce a PCR amplifikace, se provádí ve dvou krocích. Nejprve se provede reverzní transkripce z RNA templátu k získání cDNA a získaná cDNA se podrobí jedné nebo více různým reakcím PCR. Dvoukroková metoda může použít oligo (dT) nebo náhodné primery k vedení syntézy prvního vlákna cDNA a může reverzně transkribovat všechny informace o mRNA ze specifického vzorku.
Kategorie produktů
PROČ NÁS VYBRAT
Od svého založení vyvíjí naše továrna prvotřídní výrobky s dodržováním zásad
nejprve kvality. Naše výrobky získaly vynikající pověst v oboru a důvěryhodnost mezi novými i starými zákazníky.










