2 × Pfu PCR Mix
Definice aktivity
Aktivita 1 jednotky (U) Pfu DNA polymerázy je definována jako množství enzymu požadovaného pro inkorporaci 10 nmol deoxynukleotidů do látek nerozpustných v kyselině při 74 ° C do 30 minut s použitím aktivované DNA spermatu lososa jako templátu/primeru.
Kontrola kvality
Čistota pomocí detekce SDS-PAGE je více než 99%; Nebyla detekována žádná aktivita exogenní nukleázy; Jednokopírovací gen v lidském genomu by mohl být účinně amplifikován; Při skladování při pokojové teplotě po dobu jednoho týdne nedochází k žádné významné změně aktivity.
Hlavní technické parametry
Má 3'-5 'exonukleázovou aktivitu a žádnou 5'-3' exonukleázovou aktivitu. Rychlost prodloužení amplifikace DNA je nižší než u polymerázy Taq a obecně je rychlost prodloužení enzymu Pfu 0,5 až 1 kb za minutu. Tepelná stabilita Pfu je lepší než Taq. U šablon s vysokým obsahem GC lze denaturační teplotu zvýšit na 98 ° C, což nemá žádný vliv na aktivitu Pfu polymerázy. PCR produkt je s tupými konci, který může být přidán s 3'-dA přesahy před ligací vektorem TA nebo klonován vektorem s tupými konci
Aplikace
Může být použit pro vysoce věrnou amplifikaci DNA, jako je klonování genové exprese, místně zaměřená mutace, analýza jednoho nukleotidového polymorfismu (SNP) a oprava konce.
Všechny produkty lze přizpůsobit pro ODM/OEM. Pro detaily,klikněte prosím na přizpůsobenou službu (ODM/OEM)
 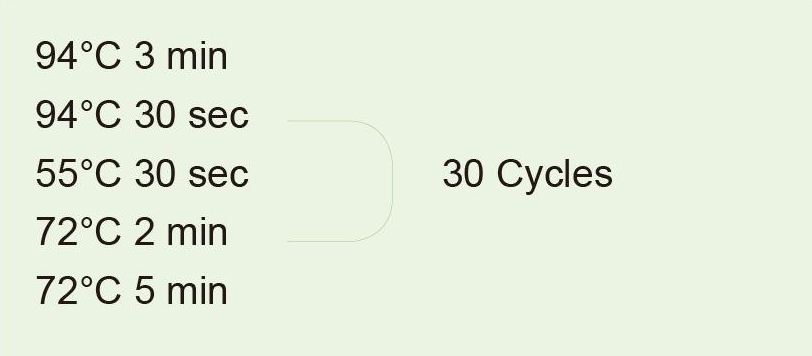 |
Pro amplifikaci 1 kB fragmentu použijte genomovou DNA jako templát. Po reakci PCR odeberte 5 μl pro detekci elektroforézy. |
Šablona A-1
■ Šablona obsahuje proteinové nečistoty nebo inhibitory Taq atd. —— Čistěte templát DNA, odstraňte proteinové nečistoty nebo extrahujte templátovou DNA pomocí purifikačních souprav.
■ Denaturace šablony není úplná —— Vhodně zvyšte denaturační teplotu a prodlužte denaturační čas.
■ Degradace šablony —— Připravte šablonu znovu.
Základní nátěr A-2
■ Špatná kvalita primerů-Znovu syntetizujte primer.
■ Degradace primerů —— Alikvotujte primery s vysokou koncentrací do malého objemu pro uchování. Vyvarujte se vícenásobného zmrazení a rozmrazení nebo dlouhodobé kryokonzervované na 4 ° C.
■ Nesprávný design primerů (např. Nedostatečná délka primeru, dimer vytvořený mezi primery atd.) -Přepracovat primery (vyhnout se tvorbě dimeru primeru a sekundární struktury)
A-3 Mg2+koncentrace
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 Teplota žíhání
■ Vysoká teplota žíhání ovlivňuje vazbu primeru a šablony. —— Snižte teplotu žíhání a optimalizujte stav s gradientem 2 ° C.
A-5 Doba prodloužení
■ Krátká doba prodloužení —— Prodlužte dobu prodloužení.
Fenomény: Negativní vzorky také ukazují pásma cílové sekvence.
A-1 Kontaminace PCR
■ Křížová kontaminace cílové sekvence nebo amplifikačních produktů —— Opatrně nepipetujte vzorek obsahující cílovou sekvenci do negativního vzorku ani je nevylijte z centrifugační zkumavky. Činidla nebo zařízení by měla být autoklávována, aby se odstranily stávající nukleové kyseliny, a existence kontaminace by měla být stanovena pomocí experimentů s negativní kontrolou.
■ Kontaminace reagencií ——Realizujte reagencie a skladujte při nízké teplotě.
A-2 Primer
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
■ Nesprávný design primerů a cílová sekvence má homologii s necílovou sekvencí. —— Přepracovat základní nátěry.
Jev: Pásy amplifikace PCR jsou v rozporu s očekávanou velikostí, buď velké nebo malé, nebo se někdy vyskytují jak specifické amplifikační pásy, tak nespecifické amplifikační pásy.
Základní nátěr A-1
■ Špatná specificita primeru
—— Re-design primer.
■ Koncentrace primeru je příliš vysoká —— Správně zvyšte denaturační teplotu a prodlužte denaturační čas.
A-2 Mg2+ koncentrace
■ Mg2+ koncentrace je příliš vysoká —— Správně snižte koncentraci Mg2+: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-3 Termostabilní polymeráza
■ Nadměrné množství enzymu —— Množství enzymu přiměřeně snižte v intervalech 0,5 U.
A-4 Teplota žíhání
■ Teplota žíhání je příliš nízká —— Vhodně zvyšte teplotu žíhání nebo použijte dvoustupňovou metodu žíhání
A-5 PCR cykly
■ Příliš mnoho cyklů PCR — Snižte počet cyklů PCR.
Základní nátěr A-1——Špatná specifičnost ——Předělejte základní nátěr, změňte polohu a délku základního nátěru, abyste zvýšili jeho specifičnost; nebo proveďte vnořenou PCR.
A-2 DNA šablony
——Šablona není čistá —— Purifikujte šablonu nebo extrahujte DNA pomocí purifikačních souprav.
A-3 Mg2+ koncentrace
——Mg2+ koncentrace je příliš vysoká —— Správně snižte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 dNTP
——Koncentrace dNTP je příliš vysoká —— Vhodně snižte koncentraci dNTP
A-5 Teplota žíhání
—— Příliš nízká teplota žíhání —— Vhodně zvyšte teplotu žíhání
A-6 Cykly
——Příliš mnoho cyklů ——Optimalizujte počet cyklů

Prvním krokem je výběr vhodné polymerázy. Běžná Taq polymeráza nemůže být zkontrolována kvůli nedostatku aktivity 3'-5 'exonukleázy a nesoulad výrazně sníží účinnost extenze fragmentů. Pravidelná Taq polymeráza proto nemůže účinně zesilovat cílové fragmenty větší než 5 kb. Taq polymeráza se speciální modifikací nebo jinou vysoce věrnou polymerázou by měla být zvolena tak, aby se zlepšila účinnost extenze a splnily potřeby amplifikace dlouhým fragmentem. Navíc amplifikace dlouhých fragmentů také vyžaduje odpovídající úpravu designu primerů, denaturační doby, prodlužovací doby, pH pufru atd. Obvykle mohou primery s 18-24 bp vést k lepšímu výtěžku. Aby se zabránilo poškození templátu, měla by být denaturační doba při 94 ° C snížena na 30 sekund nebo méně na cyklus a doba pro zvýšení teploty na 94 ° C před amplifikací by měla být kratší než 1 min. Účinnou amplifikaci dlouhých fragmentů lze navíc zajistit nastavením teploty extenze na přibližně 68 ° C a navržením doby prodloužení podle rychlosti 1 kb/min.
Chybovost PCR amplifikace může být snížena použitím různých DNA polymeráz s vysokou věrností. Ze všech dosud nalezených Taq DNA polymeráz má enzym Pfu nejnižší chybovost a nejvyšší věrnost (viz přiložená tabulka). Kromě výběru enzymů mohou vědci dále snížit rychlost mutace PCR optimalizací reakčních podmínek, včetně optimalizace složení pufru, koncentrace termostabilní polymerázy a optimalizace počtu cyklů PCR.
Kategorie produktů
PROČ NÁS VYBRAT
Od svého založení vyvíjí naše továrna prvotřídní výrobky s dodržováním zásad
nejprve kvality. Naše výrobky získaly vynikající pověst v oboru a důvěryhodnost mezi novými i starými zákazníky.








