Kit TIANcombi DNA Lyse & Det PCR
Funkce
■ Jednoduché a rychlé: DNA z různých tkání lze extrahovat za 5 minut bez nutnosti mletí tekutým dusíkem.
■ Široké použití: Použitelné pro listy rostlin, semena, tkáně zvířat, vzorky krve (čerstvá krev, antikoagulace, krevní sraženiny, zaschlé krevní skvrny atd.), Kvasinky a bakterie.
■ Silná kompatibilita: Činidlo PCR je vhodné pro amplifikaci DNA extrahované z různých zdrojů vzorků.
Aplikace
■ Detekce genů: Ideální volba pro detekci genů ve velkém měřítku.
Důležité poznámky
■ U vzorků obsahujících vysoký obsah fenolů, jako jsou listy bavlníku, by vstupní množství vzorku mělo být přísně nižší než 0,4 mg, jinak bude ovlivněna reakce PCR.
Všechny produkty lze přizpůsobit pro ODM/OEM. Pro detaily,klikněte prosím na přizpůsobenou službu (ODM/OEM)
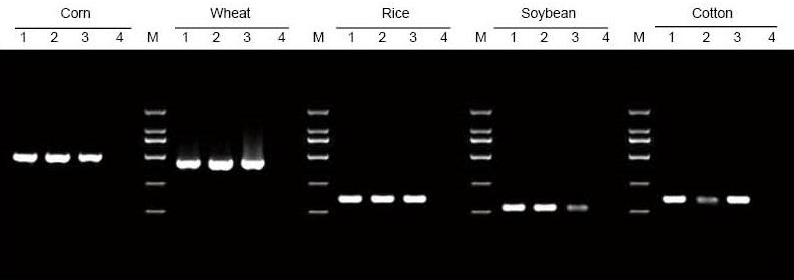 |
DNA byla extrahována z 5 mg listů a semen kukuřice, pšenice, rýže, sóji a bavlny. DNA byla amplifikována pomocí PCR za použití specifických primerů. Na dráhu bylo naneseno 6 μl DNA z celkových 20 μl eluentů. 1: Pozitivní kontrolní genom; 2: ponechte vzorky; 3: vzorky osiva; 4: NTC; 5: Primery D2000 |
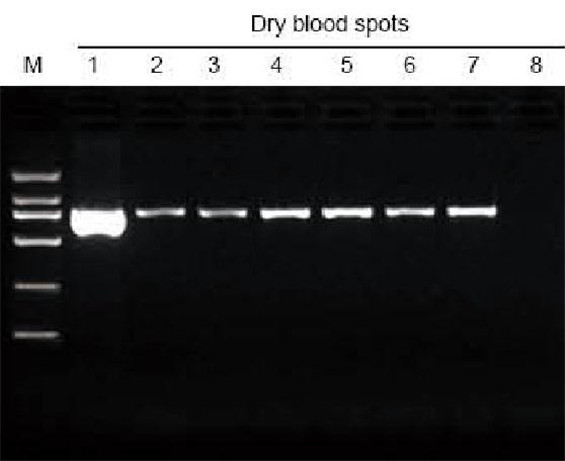 |
M: TIANGEN Marker D2000; 1: Pozitivní kontrola; 2-7: Počet zaschlých krevních skvrn na filtračním papíru je 1-6; 8: Negativní kontrola. Jako materiál pro extrakční test byl použit 3 mm děrovač k odebrání zaschlých krevních skvrn z filtračního papíru. Na dráhu bylo naneseno 6 μl DNA z celkových 20 μl eluentů. |
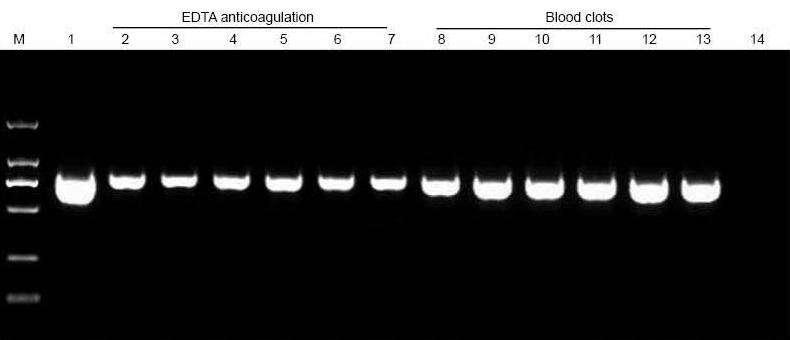 |
M: TIANGEN Marker D2000; 1: Pozitivní kontrola (jako templát byla použita genomová DNA); 2-7: Množství přidané krve je 10 μl, 20 μl, 30 μl, 40 μl, 50 μl a 60 μl; 8-13: Množství přidané krve je 10 μl, 20 μl, 30 μl, 40 μl, 50 μl a 60 μl; 14: NTC. Na agarosový gel bylo naneseno 6 μl DNA z celkových 20 μl eluentů. |
Šablona A-1
■ Šablona obsahuje proteinové nečistoty nebo inhibitory Taq atd. —— Čistěte templát DNA, odstraňte proteinové nečistoty nebo extrahujte templátovou DNA pomocí purifikačních souprav.
■ Denaturace šablony není úplná —— Vhodně zvyšte denaturační teplotu a prodlužte denaturační čas.
■ Degradace šablony —— Připravte šablonu znovu.
Základní nátěr A-2
■ Špatná kvalita primerů-Znovu syntetizujte primer.
■ Degradace primerů —— Alikvotujte primery s vysokou koncentrací do malého objemu pro uchování. Vyvarujte se vícenásobného zmrazení a rozmrazení nebo dlouhodobé kryokonzervované na 4 ° C.
■ Nesprávný design primerů (např. Nedostatečná délka primeru, dimer vytvořený mezi primery atd.) -Přepracovat primery (vyhnout se tvorbě dimeru primeru a sekundární struktury)
A-3 Mg2+koncentrace
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 Teplota žíhání
■ Vysoká teplota žíhání ovlivňuje vazbu primeru a šablony. —— Snižte teplotu žíhání a optimalizujte stav s gradientem 2 ° C.
A-5 Doba prodloužení
■ Krátká doba prodloužení —— Prodlužte dobu prodloužení.
Fenomény: Negativní vzorky také ukazují pásma cílové sekvence.
A-1 Kontaminace PCR
■ Křížová kontaminace cílové sekvence nebo amplifikačních produktů —— Opatrně nepipetujte vzorek obsahující cílovou sekvenci do negativního vzorku ani je nevylijte z centrifugační zkumavky. Činidla nebo zařízení by měla být autoklávována, aby se odstranily stávající nukleové kyseliny, a existence kontaminace by měla být stanovena pomocí experimentů s negativní kontrolou.
■ Kontaminace reagencií ——Realizujte reagencie a skladujte při nízké teplotě.
A-2 Primer
■ Mg2+ koncentrace je příliš nízká —— Správně zvyšte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
■ Nesprávný design primerů a cílová sekvence má homologii s necílovou sekvencí. —— Přepracovat základní nátěry.
Jev: Pásy amplifikace PCR jsou v rozporu s očekávanou velikostí, buď velké nebo malé, nebo se někdy vyskytují jak specifické amplifikační pásy, tak nespecifické amplifikační pásy.
Základní nátěr A-1
■ Špatná specificita primeru
—— Re-design primer.
■ Koncentrace primeru je příliš vysoká —— Správně zvyšte denaturační teplotu a prodlužte denaturační čas.
A-2 Mg2+ koncentrace
■ Mg2+ koncentrace je příliš vysoká —— Správně snižte koncentraci Mg2+: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-3 Termostabilní polymeráza
■ Nadměrné množství enzymu —— Množství enzymu přiměřeně snižte v intervalech 0,5 U.
A-4 Teplota žíhání
■ Teplota žíhání je příliš nízká —— Vhodně zvyšte teplotu žíhání nebo použijte dvoustupňovou metodu žíhání
A-5 PCR cykly
■ Příliš mnoho cyklů PCR — Snižte počet cyklů PCR.
Základní nátěr A-1——Špatná specifičnost ——Předělejte základní nátěr, změňte polohu a délku základního nátěru, abyste zvýšili jeho specifičnost; nebo proveďte vnořenou PCR.
A-2 DNA šablony
——Šablona není čistá —— Purifikujte šablonu nebo extrahujte DNA pomocí purifikačních souprav.
A-3 Mg2+ koncentrace
——Mg2+ koncentrace je příliš vysoká —— Správně snižte Mg2+ koncentrace: Optimalizujte Mg2+ koncentrace sérií reakcí od 1 mM do 3 mM s intervalem 0,5 mM pro stanovení optimálního Mg2+ koncentrace pro každý templát a primer.
A-4 dNTP
——Koncentrace dNTP je příliš vysoká —— Vhodně snižte koncentraci dNTP
A-5 Teplota žíhání
—— Příliš nízká teplota žíhání —— Vhodně zvyšte teplotu žíhání
A-6 Cykly
——Příliš mnoho cyklů ——Optimalizujte počet cyklů

Prvním krokem je výběr vhodné polymerázy. Běžná Taq polymeráza nemůže být zkontrolována kvůli nedostatku aktivity 3'-5 'exonukleázy a nesoulad výrazně sníží účinnost extenze fragmentů. Pravidelná Taq polymeráza proto nemůže účinně zesilovat cílové fragmenty větší než 5 kb. Taq polymeráza se speciální modifikací nebo jinou vysoce věrnou polymerázou by měla být zvolena tak, aby se zlepšila účinnost extenze a splnily potřeby amplifikace dlouhým fragmentem. Navíc amplifikace dlouhých fragmentů také vyžaduje odpovídající úpravu designu primerů, denaturační doby, prodlužovací doby, pH pufru atd. Obvykle mohou primery s 18-24 bp vést k lepšímu výtěžku. Aby se zabránilo poškození templátu, měla by být denaturační doba při 94 ° C snížena na 30 sekund nebo méně na cyklus a doba pro zvýšení teploty na 94 ° C před amplifikací by měla být kratší než 1 min. Účinnou amplifikaci dlouhých fragmentů lze navíc zajistit nastavením teploty extenze na přibližně 68 ° C a navržením doby prodloužení podle rychlosti 1 kb/min.
Chybovost PCR amplifikace může být snížena použitím různých DNA polymeráz s vysokou věrností. Ze všech dosud nalezených Taq DNA polymeráz má enzym Pfu nejnižší chybovost a nejvyšší věrnost (viz přiložená tabulka). Kromě výběru enzymů mohou vědci dále snížit rychlost mutace PCR optimalizací reakčních podmínek, včetně optimalizace složení pufru, koncentrace termostabilní polymerázy a optimalizace počtu cyklů PCR.
Kategorie produktů
PROČ NÁS VYBRAT
Od svého založení vyvíjí naše továrna prvotřídní výrobky s dodržováním zásad
nejprve kvality. Naše výrobky získaly vynikající pověst v oboru a důvěryhodnost mezi novými i starými zákazníky.








